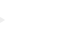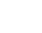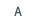- 医療法人清仁会>
- 水無瀬病院>
- 診療科のご案内>
- 一般・消化器外科・胃腸科>
- 肝臓疾患
肝臓について
※図は日本消化器外科学会ホームページ(2020年2月)から引用
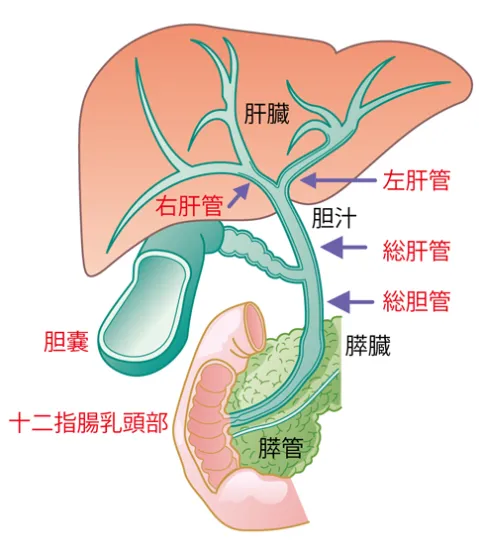
肝臓は、右の肋骨に囲まれるように存在する身体のなかで最も大きい臓器であり、赤褐色調、重さは1,000~1,500gあります。
肝臓は生体の化学工場であり、糖質、蛋白質、脂質などの代謝や、種々の物質の解毒・排泄機能を行います。
また、胆汁という消化液の合成を行ったり免疫系にも大きく関与しています。
- 蛋白の合成、栄養の貯蔵
- 解毒・分解
- 胆汁の合成・分泌
肝臓の病気
肝炎
ウィルス感染、アルコール、生活習慣病や薬剤などが原因で、肝臓が炎症を起こした状態です。原因の多くがウィルス性肝炎であり、特にB型肝炎ウィルスとC型肝炎ウィルスが問題となっています。
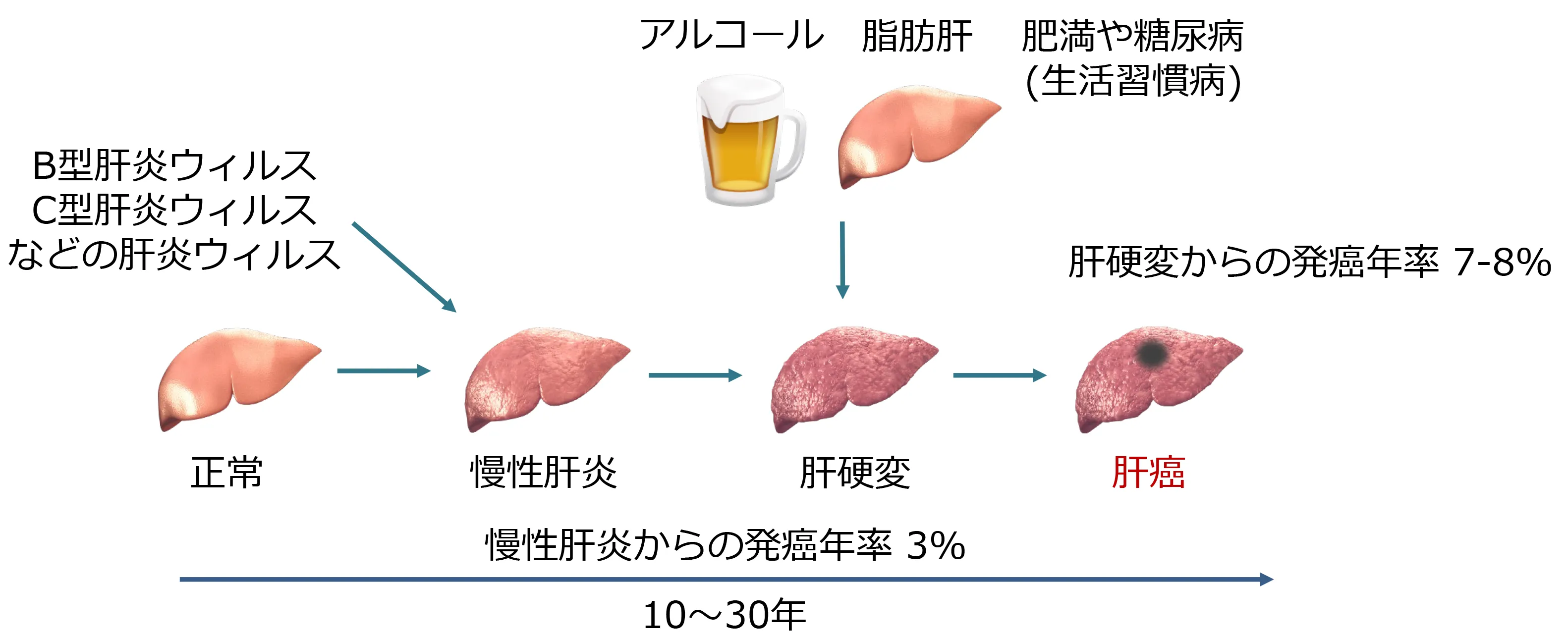
肝硬変
ウィルス性肝炎などが進行することにより徐々に肝臓が線維化して硬くなってしまいます。
この状態になると、肝臓の機能が著しく低下し、
- 黄疸(皮膚、眼球、粘膜や体液が黄色に染まる)
- 肝性脳症(錯乱状態に陥ったり、意識が混濁する状態)
- 食道・胃静脈瘤(食道や胃周囲の静脈に瘤ができて、破裂すると大出血を起こす)
- 腹水(お腹に水が貯まり、呼吸困難を起こすこともある)
- 浮腫(皮膚の下にある皮下組織に余分な水分が貯まる)
などの症状が出ます。
しかし、肝硬変そのものを治療する方法はありません。
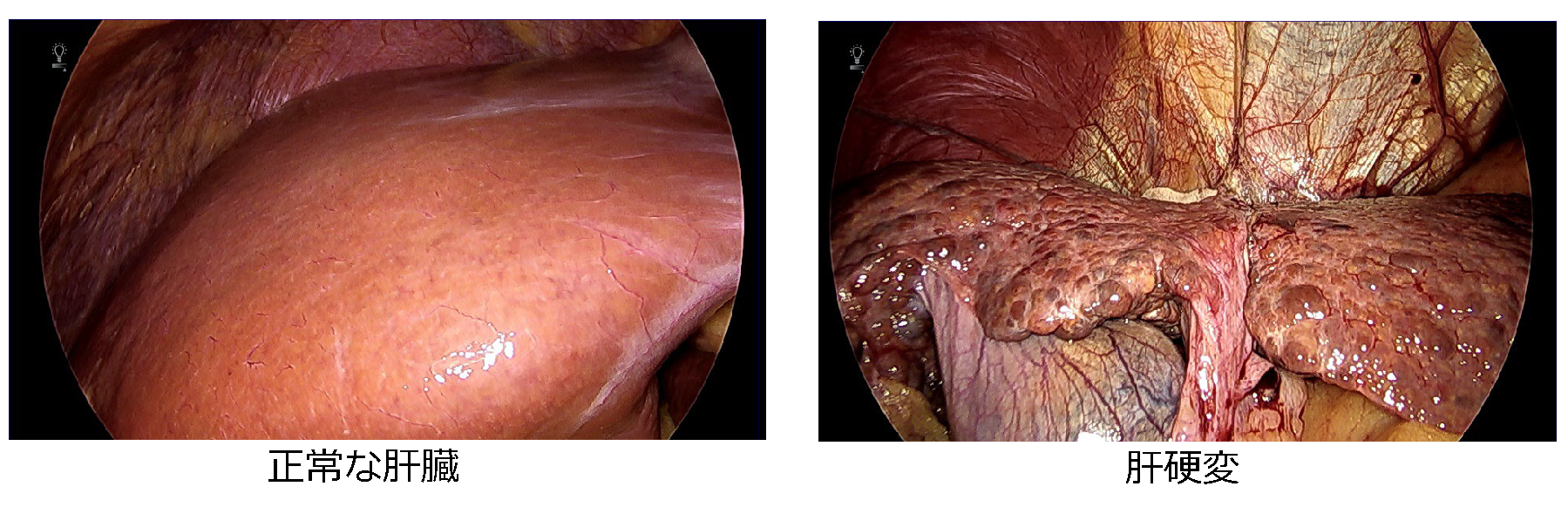
肝癌
肝臓に発生する癌には、
- 原発性肝癌(肝臓自体から発生する)
- 肝血管肉腫(血管内皮細胞から発生する)
- 粘液嚢胞腺癌
- 転移性肝癌(大腸癌や胃癌をはじめとする他臓器の癌が肝臓に転移する)
があります。
肝切除術の対象となる疾患には下記のようなものがあります。
- 原発性肝癌(肝細胞癌、肝内胆管癌、混合型肝癌など)
- 胆道癌(肝門部胆管癌、胆嚢癌、上・中・下部胆管癌など)
- 転移性肝癌(大腸癌など他臓器癌からの肝転移など)
- 良性腫瘍(肝血管腫、肝腺腫、肝嚢胞など)
- 肝膿瘍など
当院の肝切除術の実施状況
当院では原発性肝癌、胆管癌、転移性肝癌などを中心とした肝腫瘍に対し肝切除術を実施しております。 肝切除術は術中・術後出血、術後胆汁漏や肝不全などを併発する可能性のある手術です。
当院での手術は、肝胆膵高度技能専門医、日本内視鏡外科学会技術認定医(肝)、肝臓専門医である医師の執刀のもと安全に切除できる様に体制を整えています。
さらに、術前、術後の患者さんの管理において、安全に手術を受け、退院していただけるよう努力しております。
また、当院に導入されております腹腔鏡下手術を積極的に取り組んでおります。
手術適応、術式選択や、肝切除についての質問は、当院消化器外科・胃腸科の肝胆膵専門医にいつでもお尋ねください。
肝胆膵高度技能専門医
肝胆膵外科手術は、消化器外科領域の中でも難易度が非常に高く、豊富な経験と高度な技量が必要とされています。
日本肝胆膵外科学会では「安全に、かつ、確実に行うことができる外科医を育成し、認定する制度」を確立するために、肝胆膵外科高度技能専門医制度を2008年より発足しました。
高度技能専門医の資格を得るためには、外科専門医、さらに消化器外科専門医(指定修練施設で450例以上の消化器外科手術を経験)の資格を持っていることを前提に、修練施設で経験を積み、高難度の肝胆膵外科手術の執刀実績が必要です。そのうえで、自らが行った高難度肝胆膵外科手術の無編集ビデオ審査を受けて合格すると、高度技能専門医になることができます。
2018年度までに日本全国で265名が認定されており、2019年の時点で大阪府内の病院に在籍する高度技能専門医は25名のみ※です。
当院は肝胆膵高度技能専門医が勤務している数少ない施設(府内で14施設のみ)です。
日本内視鏡外科学会技術認定医(肝)
内視鏡外科手術は、低侵襲的であるなどの利点から、多数の領域の手術に応用されていますが、内視鏡下の手術野で、特殊な器具を用いて行う手術であり、高度な技術が要求されます。
日本内視鏡外科学会では「内視鏡手術に携わる医師の技術を高い基準にしたがって評価し、後進を指導するにたる所定の基準を満たした者を認定する」ために、日本内視鏡外科学会 技術認定制度を発足しました。
技術認定の資格を得るためには、外科専門医の資格を持っていることを前提に、内視鏡外科の修練を行い、高難度の内視鏡外科手術の執刀実績が必要です。そのうえで、自らが行った腹腔鏡下肝切除術の無編集ビデオ審査を受けて合格すると、技術認定医になることができます。
2019年度までに消化器・一般外科領域(肝臓)では日本全国で37名が認定されており、2019年の時点で大阪府内の病院に在籍する技術認定医(肝)は3名のみ※です。
当院は日本内視鏡外科学会技術認定医(肝)が勤務している数少ない施設です。
肝細胞がんの治療法
肝細胞癌の治療方法には
- 肝切除術
- 経皮的局所療法(RFA、MCT、PEITなど)
- 肝動脈化学塞栓術(TACE)、肝動注化学療法(TAI)
- 薬物療法
- 肝移植術
- 緩和医療
があり、当院では肝切除術を中心に様々な治療を行っています。
一般的に、癌そのものに対する治療効果は肝切除術が他の治療法よりも優れています。
しかし、開腹肝切除は治療後の肝機能に与えるダメージが大きくなります。特に肝細胞癌の患者さんでは、肝臓自体がウィルス性肝炎・肝硬変、あるいは脂肪肝によって障害を受けている場合が多いので、治療に際して癌の性質(数や大きさ)だけでなく残る肝臓による機能温存も考慮する必要があります。
当院では肝癌診療ガイドラインに従い、治療効果と安全性の両者に配慮した最善の治療法を提供するように努めております。
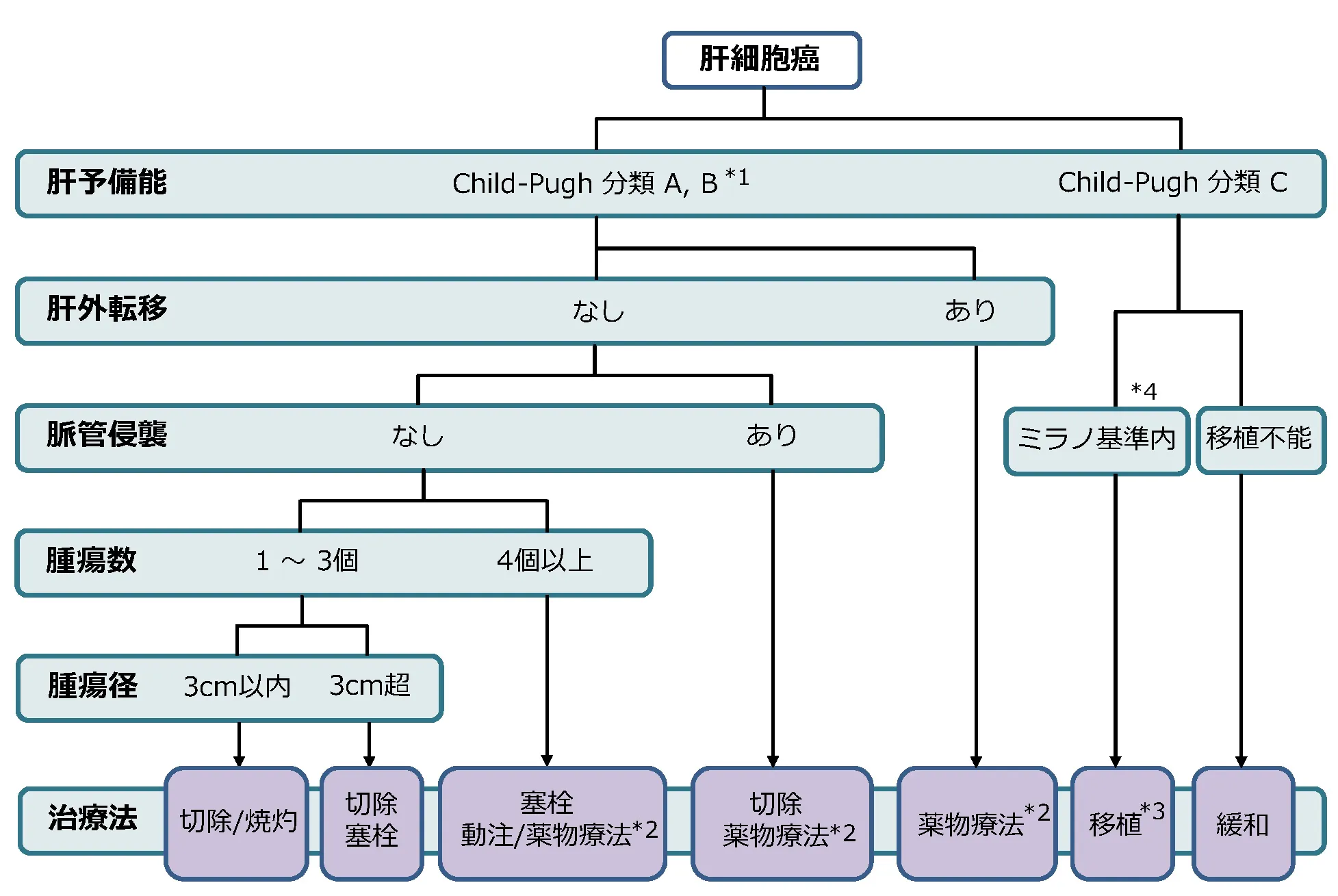
治療法について、2段になっているものは上段が優先される。スラッシュはどちらも等しく推奨される。
*1:肝切除の場合は肝障害度による評価を推奨
*2:Child-Pugh 分類 Aのみ
*3:患者年齢は65歳以下
*4:遠隔転移や脈管侵襲なし、腫瘍径5cm以内かつAFP500ng/mL以下
肝切除術
外科的に癌を切除する方法です。周囲の肝組織を含めて病巣を摘出するので、最も確実な治療法といえます。切り取る肝臓の大きさは、癌の位置、大きさ、血管へ及んでいる程度など、癌に関係した因子と、肝機能や全身状態といった患者さん自身に関する因子から決定します。
これまで肝切除術・血管合併切除・腹腔鏡下手術など高難度手術から体に優しい低侵襲手術まで症例に応じて多彩な治療法を駆使して良好な成績をあげてきました。
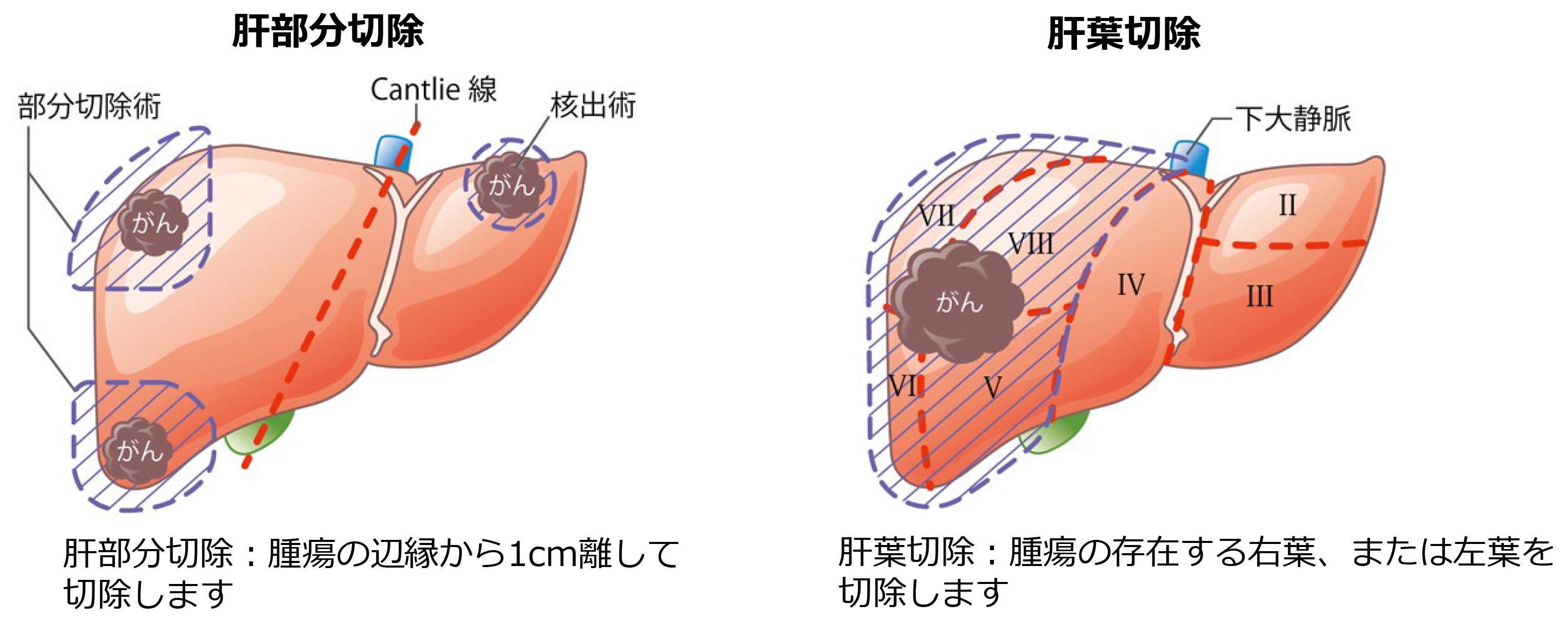
※図は日本消化器外科学会ホームページ(2020年2月)から引用
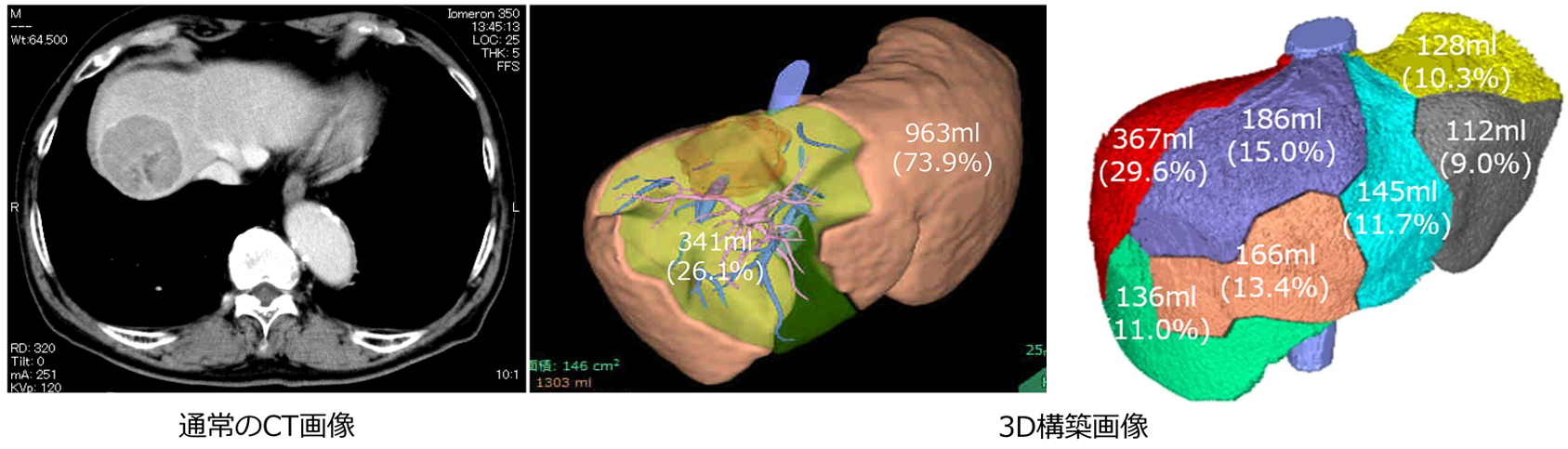
①3D画像解析システム
3D肝切除シミュレーション
当院では、最新の画像診断技術として、3D画像解析システムの導入により、腫瘍の存在部位、脈管のバリエーションや腫瘍との位置関係、切除肝および残肝容量の正確な評価を手術前に行います。さらに、構築された3D画像より、想定される肝切離線、切離線上の脈管部位を把握することで、安全性及び合理性を向上した肝切除を行っています。
通常のCT画像
3D画像解析システムによるサルコペニアやフレイルの評価
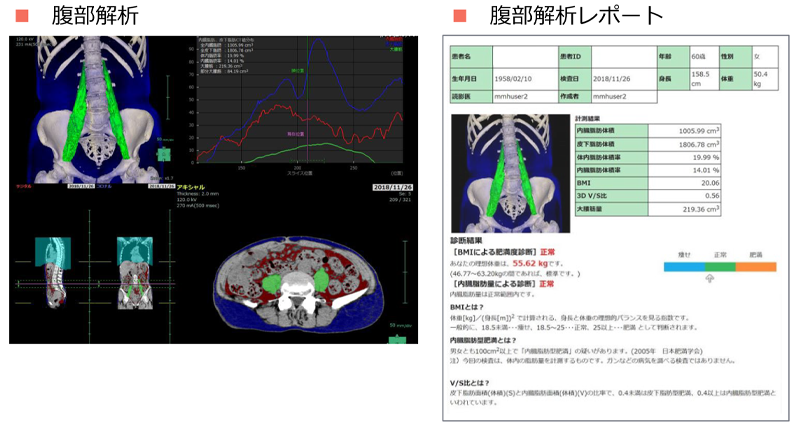
超高齢社会に突入した現代では、加齢などに伴い筋力、身体機能が低下していく「サルコペニア」や「フレイル」への対策が重要視されています。当院では3D画像解析システムにより皮下脂肪、内臓脂肪、筋肉量の正確な評価を行い、入院中および周術期における筋力・機能低下対策に取り組んでいます。
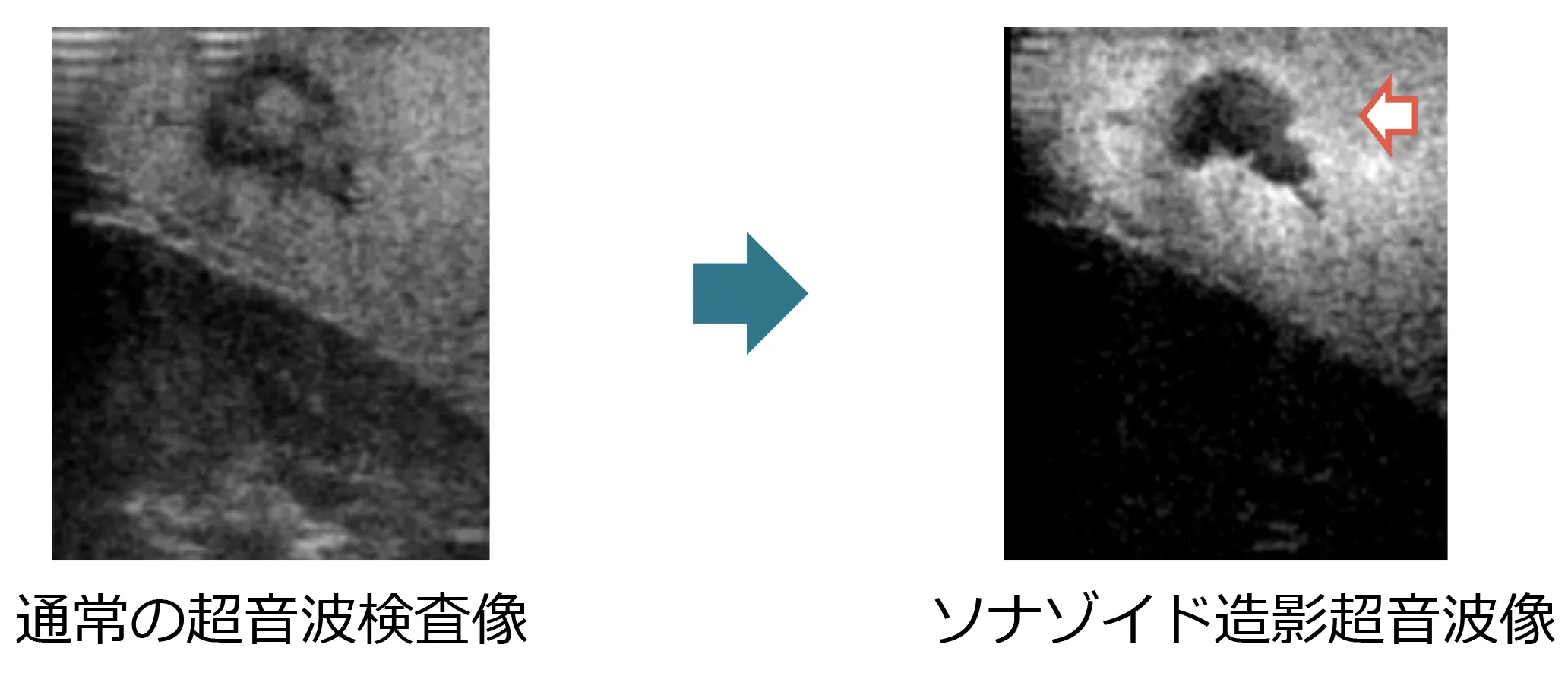
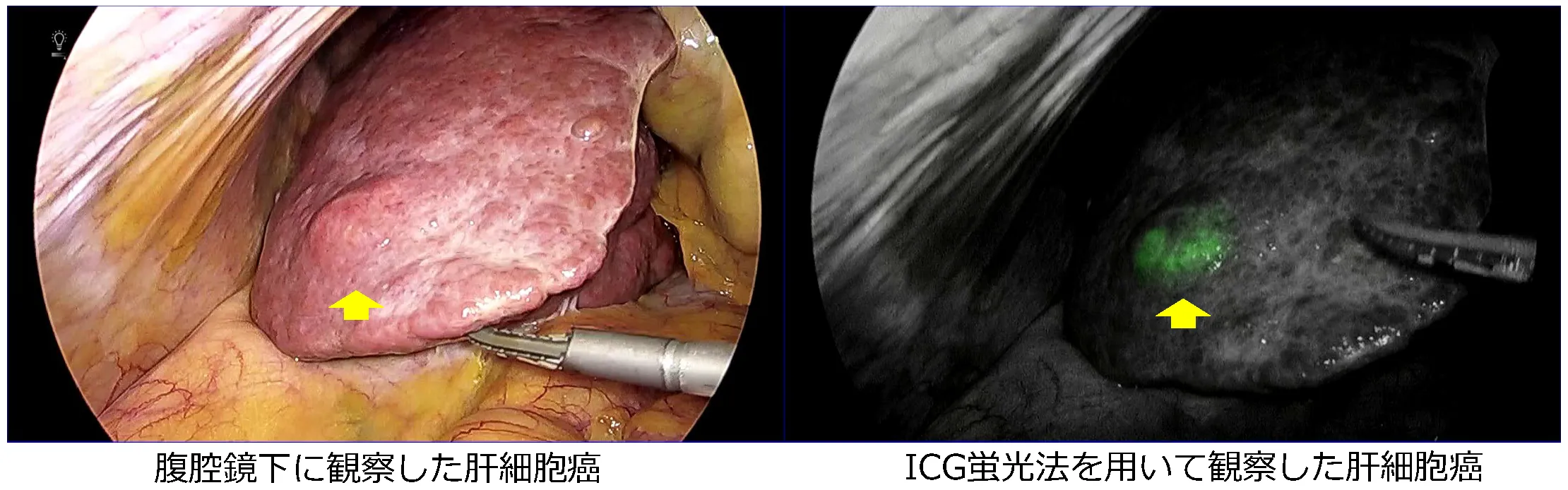
②ソナゾイド造影超音波検査
ソナゾイド®は造影効果が高く、気泡が壊れない程度のやや低い音圧で気泡を共振させて可視化することにより、染影の時相による変化を連続動画像として容易に観察できます。
極めて安定した超音波像を得ることが出来る特徴をもっており、微小な腫瘍や検出困難な腫瘍などにおいて、ソナゾイド®を用いた術中超音波検査を行うことで検出力を向上させることができます。
われわれは肝切除術中に常にソナゾイド®を用いた造影超音波検査を行っており、術中に更なる精査をおこない術後成績の改善に努めております。
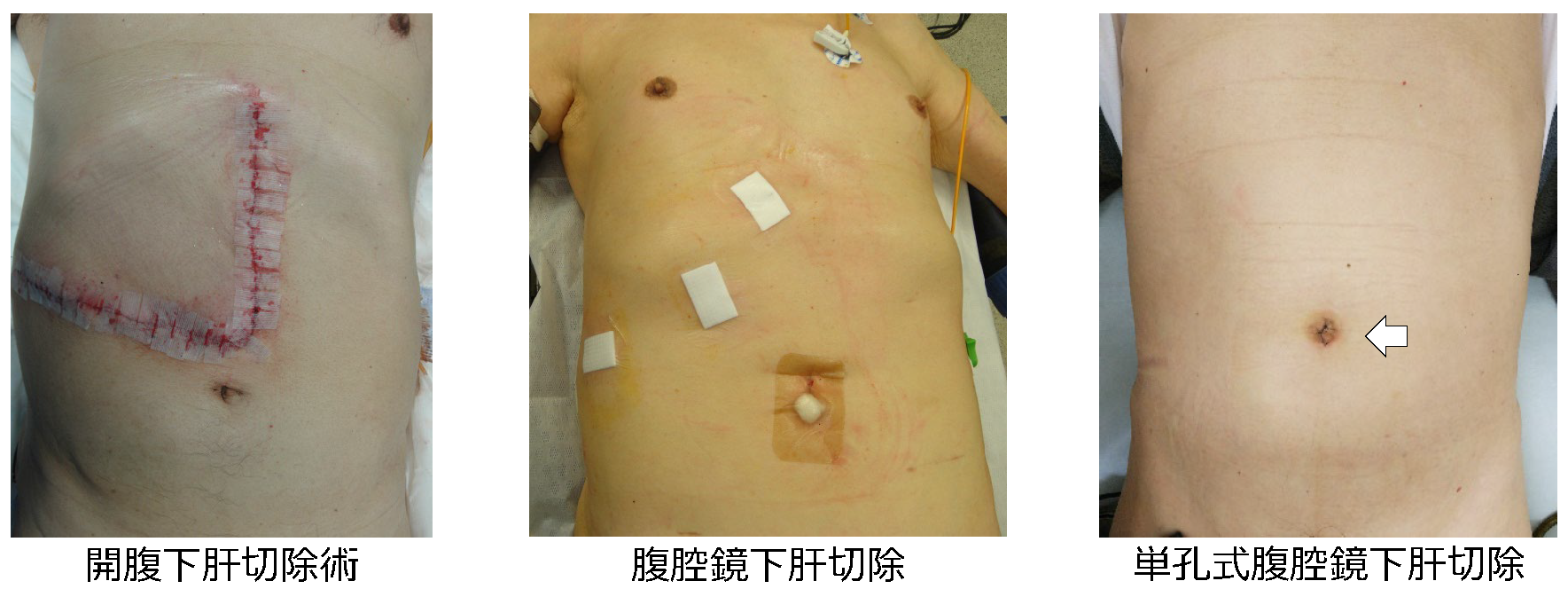
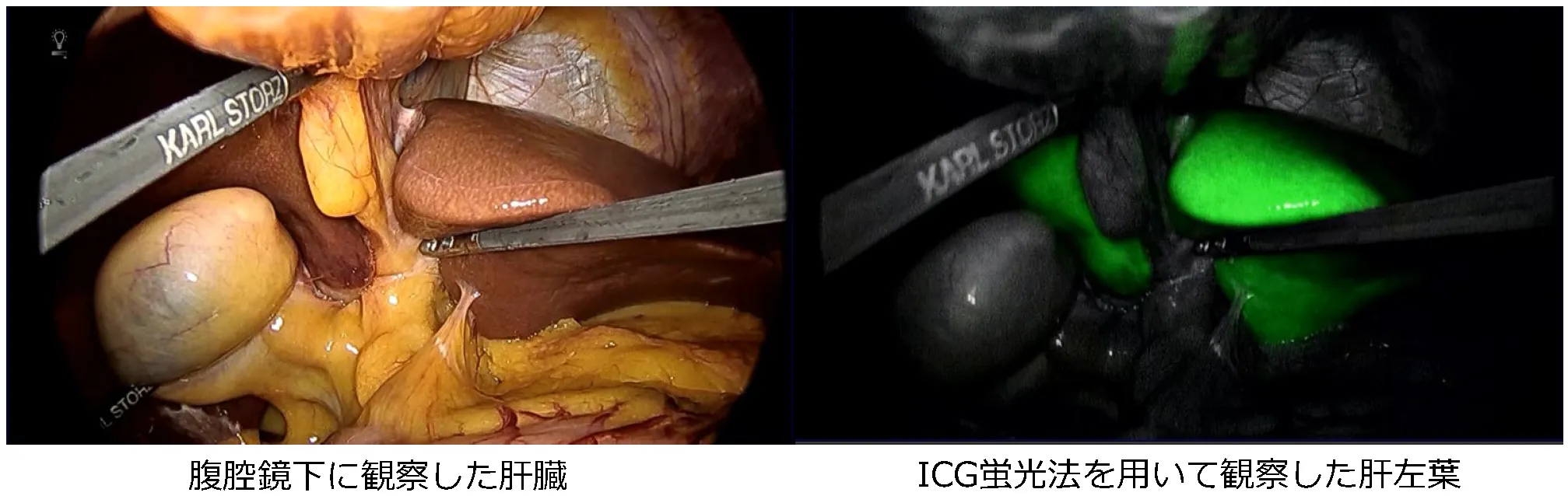
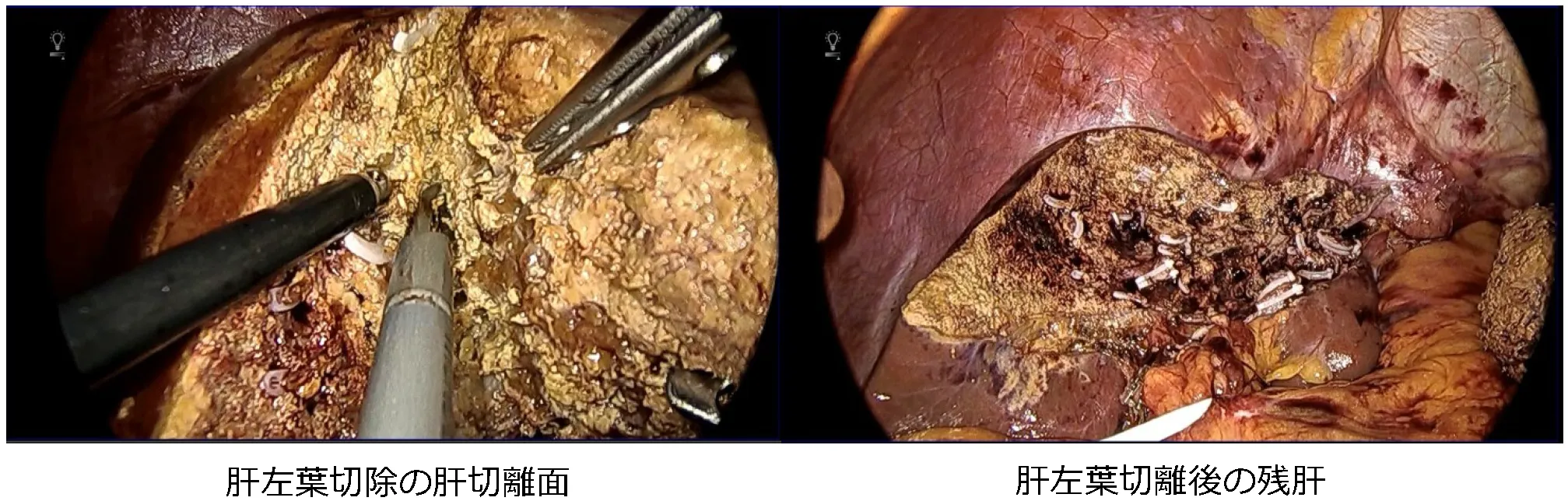
③腹腔鏡下肝切除術
近年、腹腔鏡下肝切除術は保険収載に伴って急速に広まりつつあり、適応や術式も拡大傾向にあります。2021年12月までに556例の腹腔鏡下肝切除を経験しており、導入当初は肝の腹側縁や表面にある腫瘍に対する肝部分切除のみを適応としていましたが、現在では肝門部処理による系統的肝切除も行ってきました。
腹腔鏡肝切除術における長所としては、
- 術後疼痛が少ない
- 早期に離床が図れる
- 美容面で優れる
- 術中出血量が軽減する
- 術後合併症が少ない
- 術後在院日数が短い
などが挙げられます。
腹腔鏡下肝S4/8部分切除術
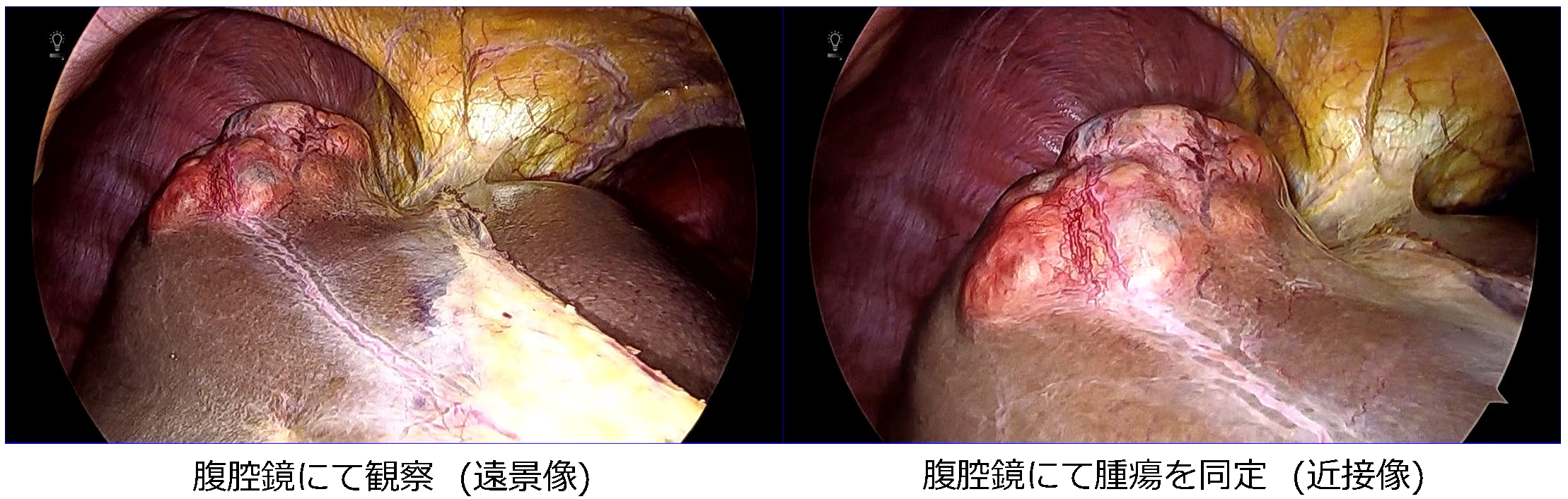
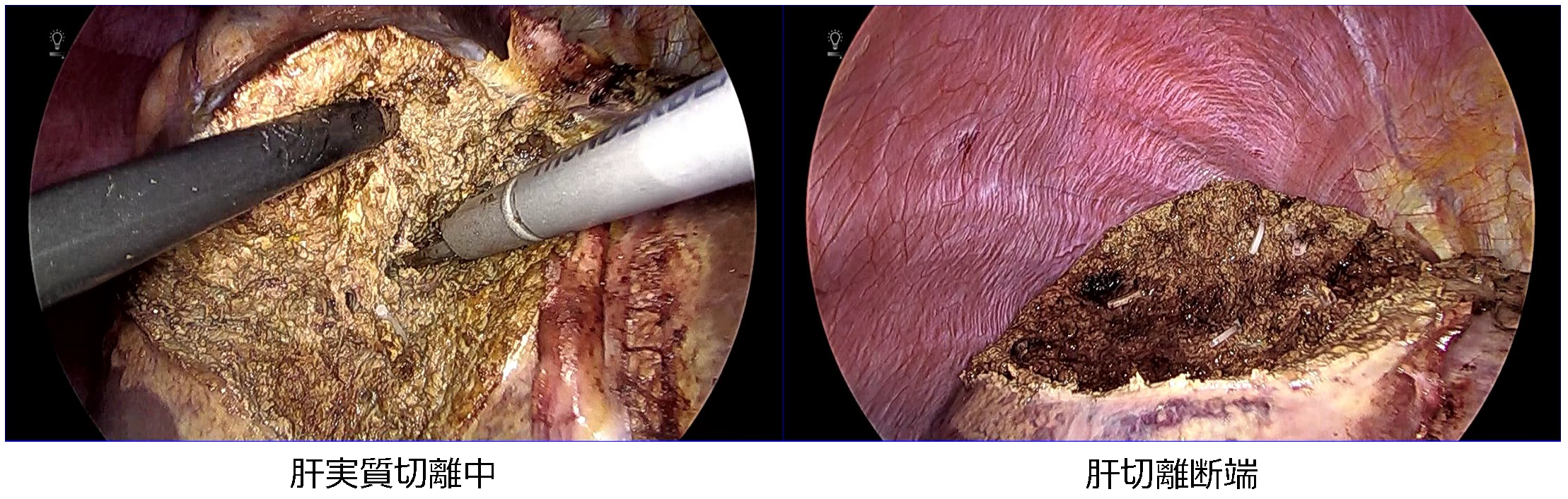
腹腔鏡下肝左葉切除術
腹腔鏡下肝S7/6部分切除術
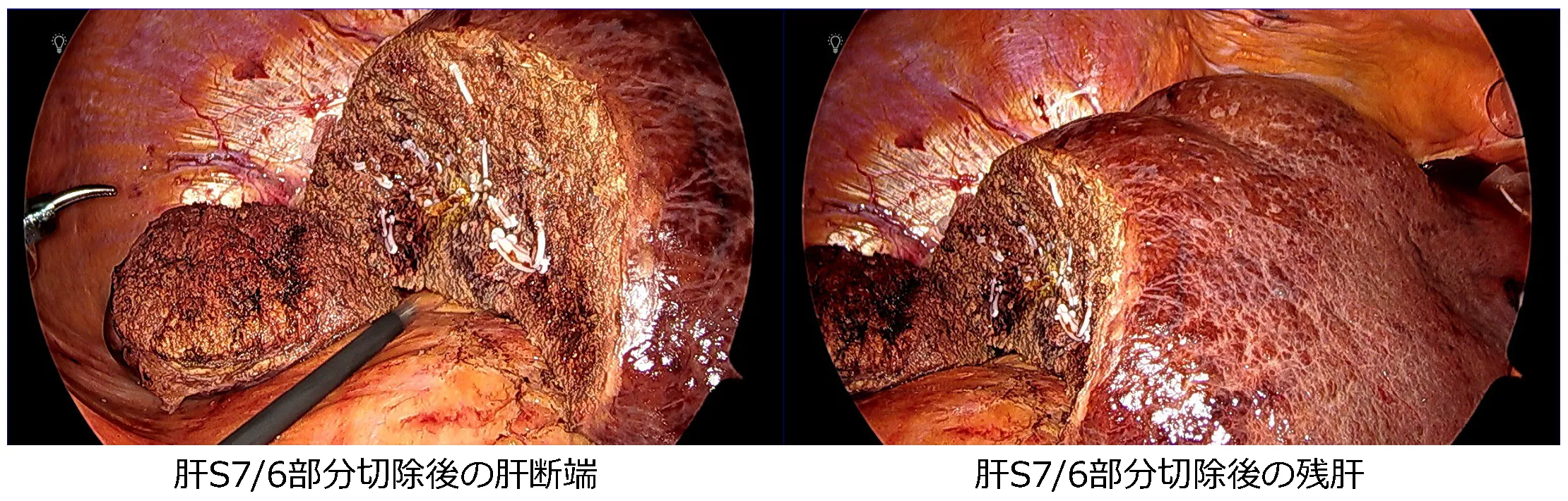
腹腔鏡下肝S6部分切除術
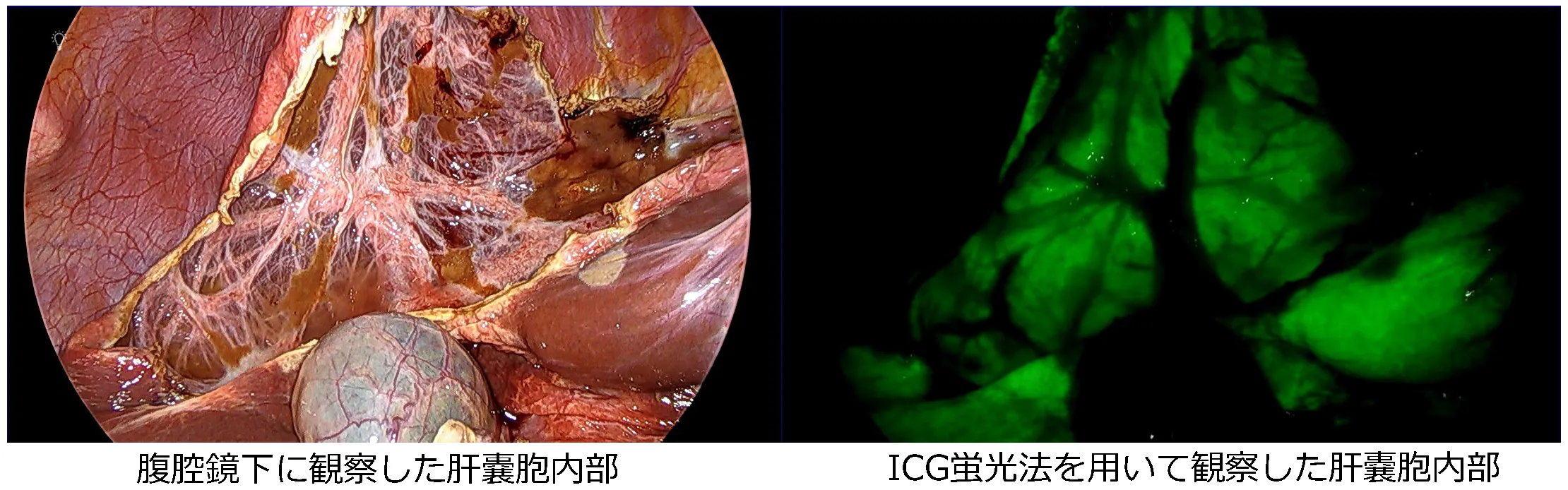
腹腔鏡下肝嚢胞開窓術
肝細胞癌への薬物療法
薬物療法は、外科切除や肝移植、穿刺局所療法、TACEなどが適応とならない進行肝細胞癌で、PS良好かつ肝予備能が良好なChild-Pugh分類A症例が適応となります。
2009年に初めて分子標的剤のソラフェニブ(ネクサバール®)が承認されて以来、
2017年 レゴラフェニブ(スチバーガ®)
2018年 レンバチニブ(レンビマ®)
2019年 ラムシルマブ(サイラムザ®)
2020年 カボサンチニブ(カボメティックス®)
2021年12月より、アテゾリマブ(テセントリク®)+ベマシズマブ(アバスチン®)が承認され、切除不能な肝細胞癌に対する1次治療として位置づけられています。
薬物療法
現在、肝細胞癌には6種類の治療薬剤が使用できます。アテゾリマブ(テセントリク®)+ベマシズマブ(アバスチン®)の併用が、切除不能な肝細胞癌に対する1次治療として位置づけられています。
2次治療としてはレンバチニブ(レンビマ®)またはソラフェニブ(ネクサバール®)が推奨され、3次治療はレゴラフェニブ(スチバーガ®)、ラムシルマブ(サイラムザ®)、カボサンチニブ(カボメティックス®)および2次治療で使用されなかった薬剤が推奨となっています。
肝細胞癌の薬物療法

アテゾリマブ(テセントリク®)+ベマシズマブ(アバスチン®)併用療法とは?
アテゾリマブ(テセントリク®):免疫チェックポイント阻害剤
ベマシズマブ(アバスチン®):分子標的薬
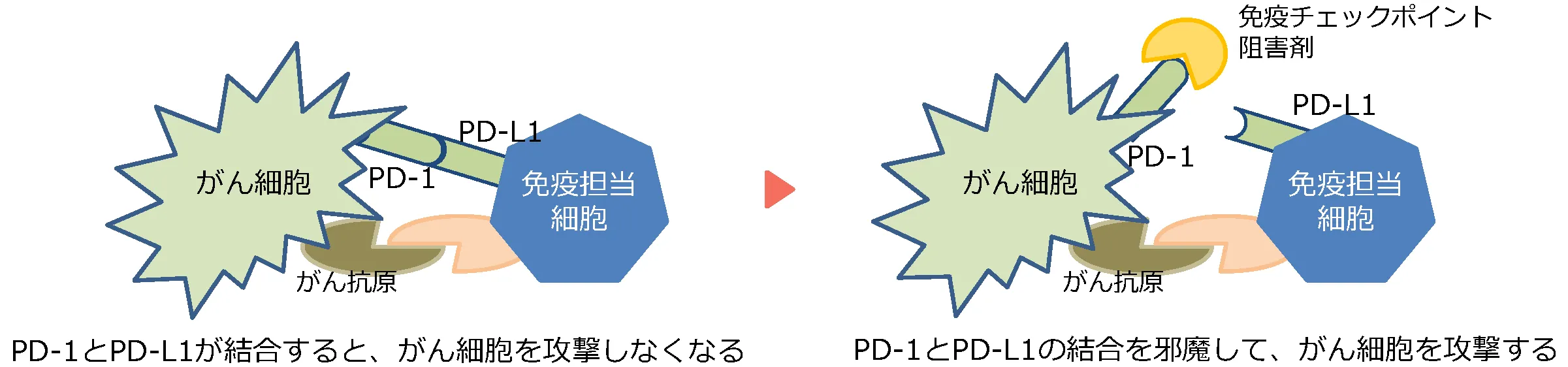
免疫は体の中の異物を除去するのに有効な仕組みですが、がん細胞を攻撃する免疫細胞の『PD-1』と、
がん細胞が出している『PD-L1』がくっつくと、免疫細胞ががん細胞を攻撃できなくなります。この機構を京都大学の本庶佑先生が解明し、2018年にノーベル医学・生理学賞を受賞しました。
免疫チェックポイント阻害薬は、がん細胞を攻撃する免疫細胞にブレーキをかけてしまうPD-1あるいはPD-L1にくっついて、ブレーキを外し、免疫細胞の働きを強めて、がん細胞を攻撃できるようになります。
治療スケジュール
(例)アテゾリマブ(テセントリク®)+ベマシズマブ(アバスチン®)併用療法
免疫チェックポイント阻害剤
・アテゾリマブ:1,200mg
分子標的薬
・ベバシズマブ:15mg/kg

当施設で行っているアテゾリマブ+ベバシズマブ併用療法の流れについて紹介します。
アテゾリマブ(1,200mg)を30~90分かけて点滴します。次に、ベバシズマブ(15mg/kg:体重1kg当たり)を30~90分かけて点滴します。これを1コースとして3週間ごとに行います。
治療効果
治療効果の評価は主にCTを使用し、腫瘍マーカー(AFPなど)も画像評価の補助的診断に用います。
効果判定として画像上の腫瘍径の変化の評価が基本となります。判定結果は、がんが分からなくなった「完全奏効(CR:complete response)」、大きさが30%以上縮小した「部分奏効(PR:partial response)」、20%以上増大した「進行(PD:progressive disease)」、30%未満の縮小から20%未満の増大を「安定(SD:stable disease)」の4つに分類されます。
治療効果判定のための検査間隔としては、病状に応じて2~4ヶ月ごとに行っています。
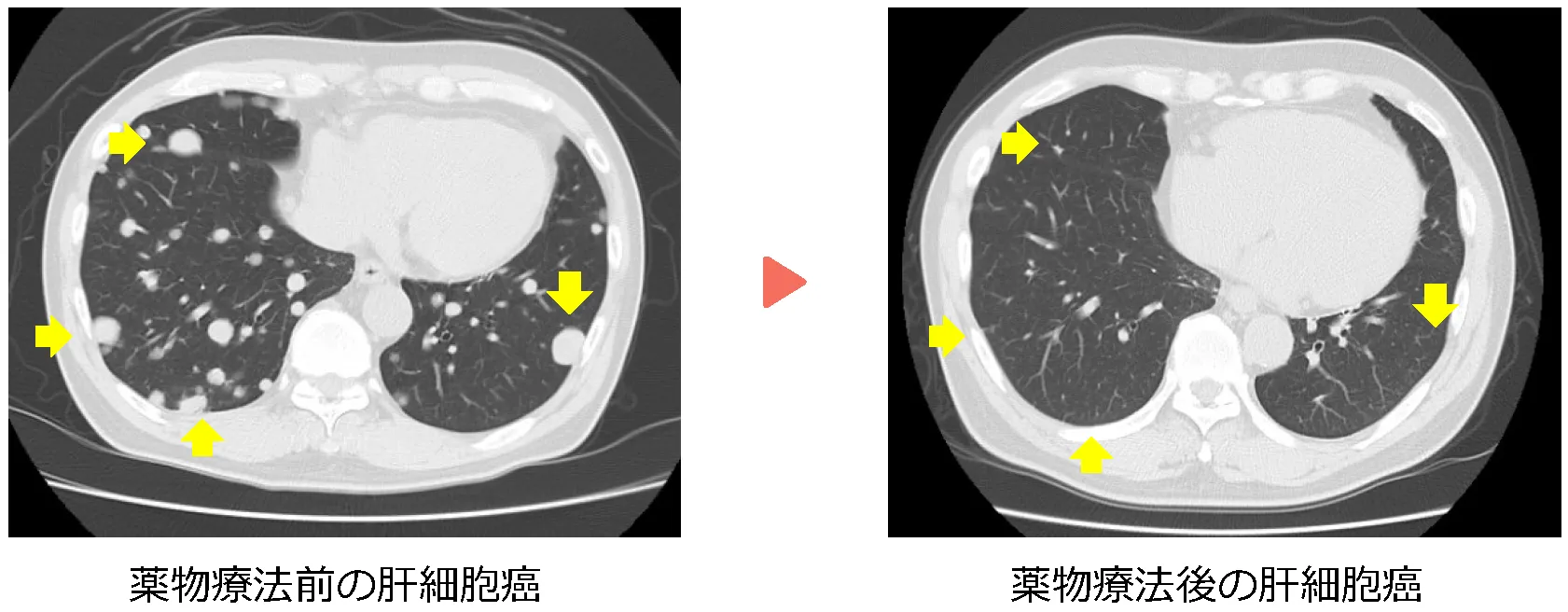
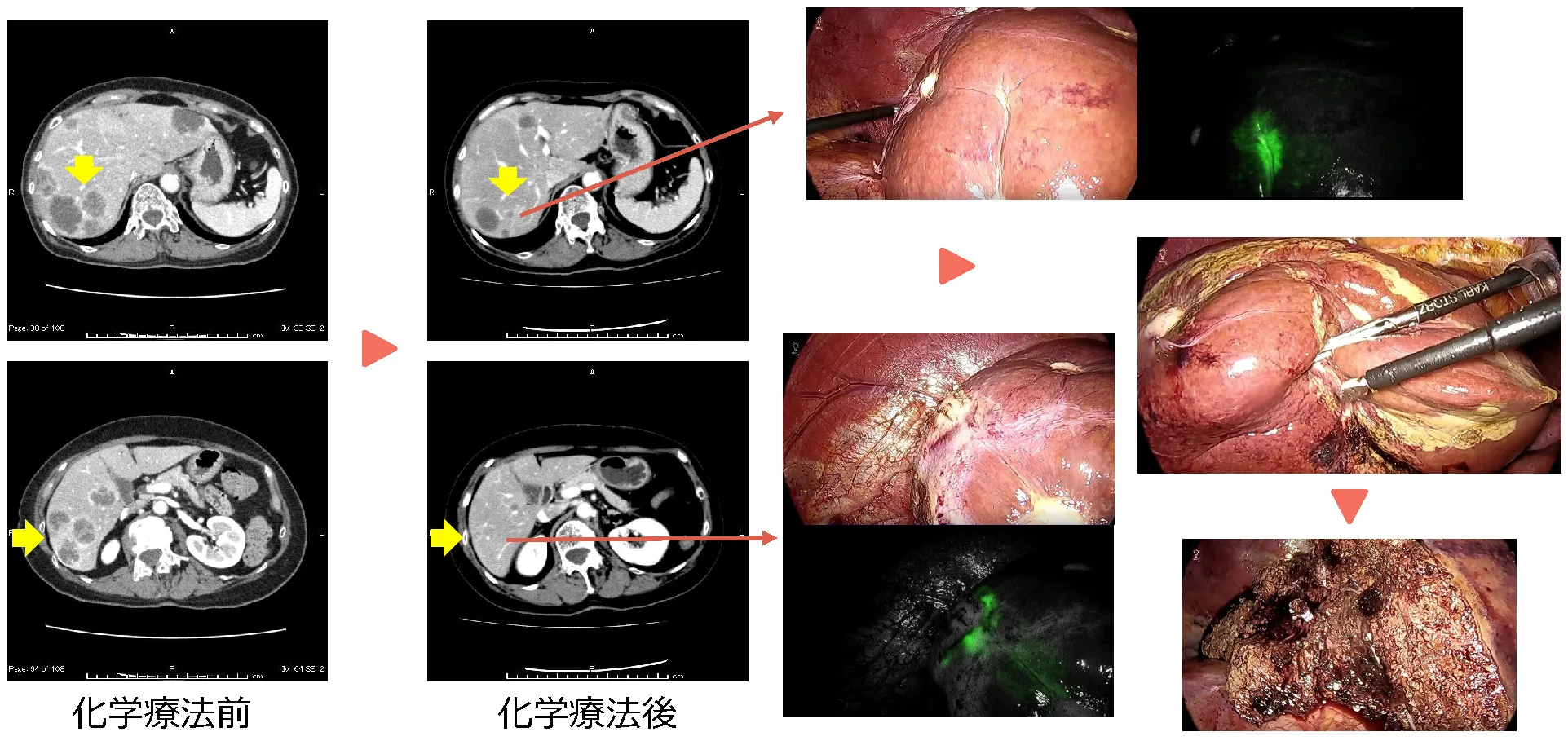
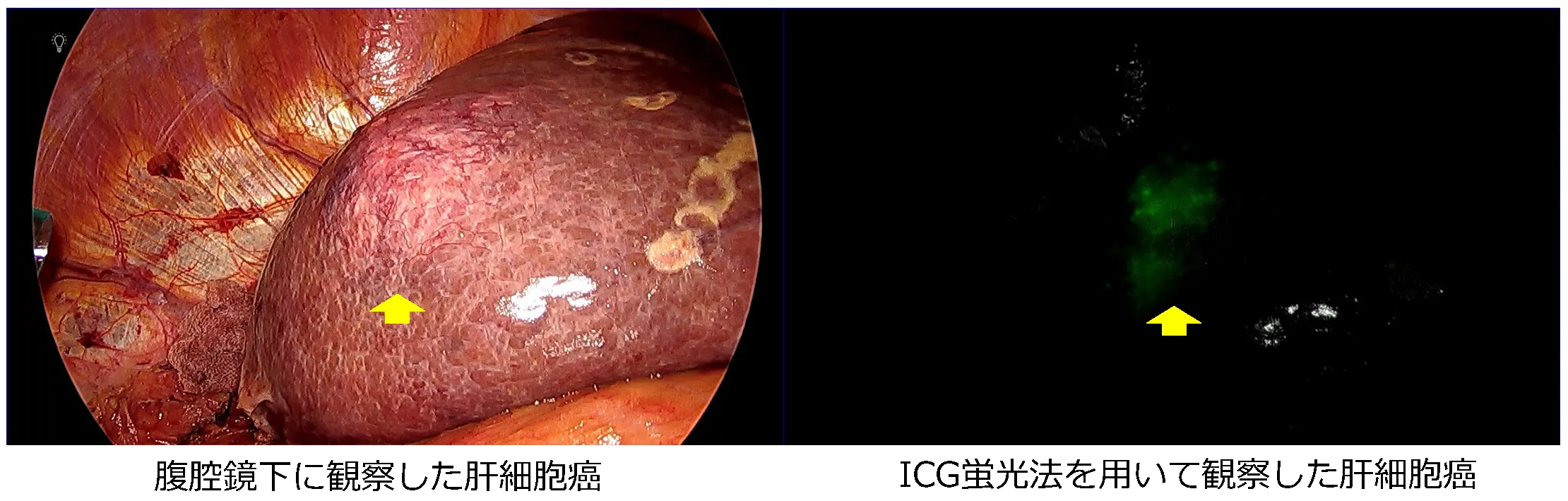
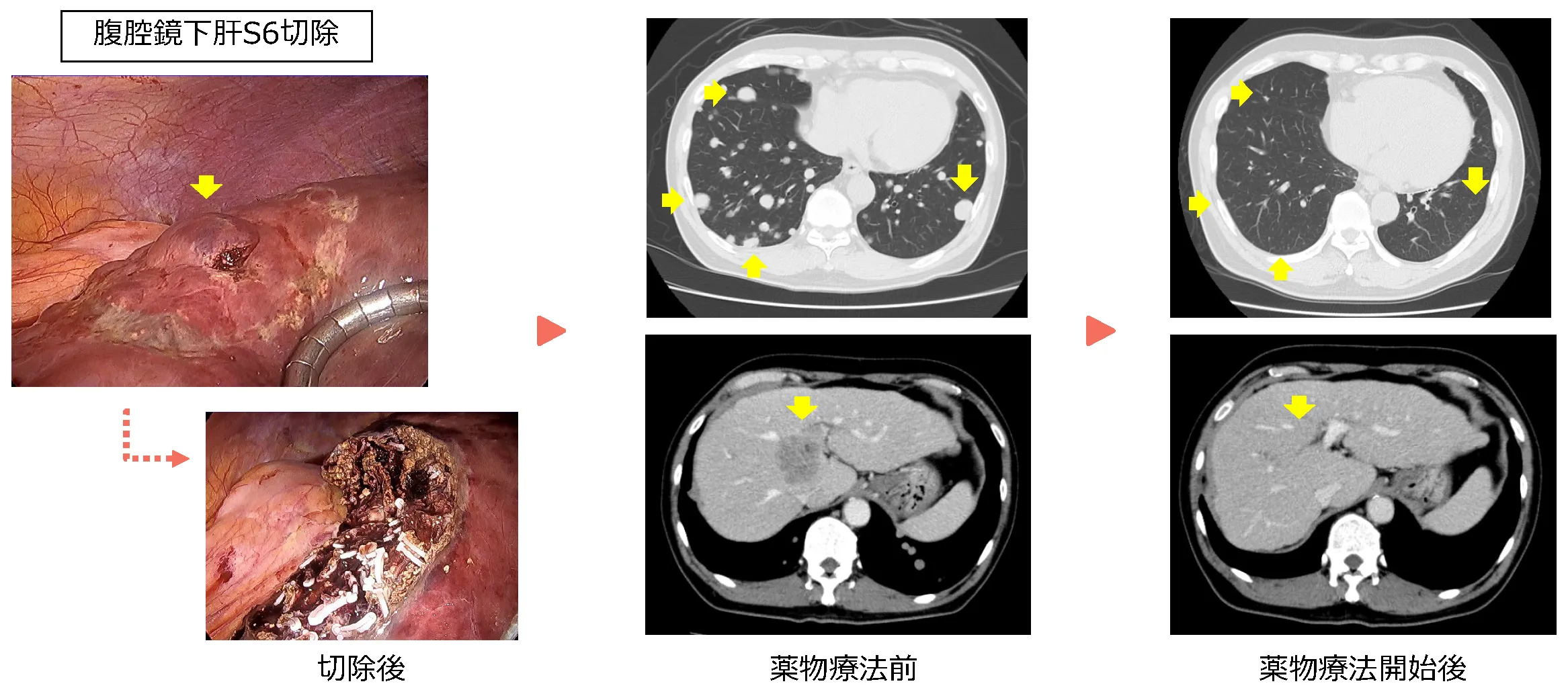
症例:61歳 男性
20XX年11月に肝細胞癌に腹腔鏡下肝S6切除(図)、術1年5ヶ月後、残肝再発に対し腹腔鏡下再肝S6切除、2年2ヶ月後に肝S3、S4ラジオ波焼灼療法を施行。その後、2年3ヶ月後に骨転移を認め放射線療法、2年4ヶ月後には多発肺・肝再発に対し、アテゾリマブ+ベバシズマブ併用療法を開始。
転移性肝癌
転移性肝癌とは、肝臓以外の臓器に発生した悪性腫瘍が肝臓に転移したものを指し、その発生頻度は原発性肝癌より多いとされています。
転移性肝癌の原発巣としては、臨床上頻度が高いのは消化器癌(大腸癌、胃癌、膵癌、胆管癌など)であり、このほか乳癌、肺癌、頭頸部癌、婦人科癌(子宮癌や卵巣癌)、腎癌などのほか、平滑筋肉腫、カルチノイド、神経内分泌腫瘍の転移性肝癌を認めることもあります。
大腸癌以外の疾患の転移性肝癌に対する肝切除術の有効性は、必ずしも明らかにはなっていません。重要なのは癌自体の生物学的悪性度であり、大腸癌や神経内分泌腫瘍などは悪性度が低く肝切除術による局所療法が奏効する場合が多いですが、膵癌、胆管癌などでは悪性度が高く、他の遠隔転移を伴うことがあり、全身化学療法の適応となることが多くなります。
大腸癌の転移性肝癌
大腸癌の転移性肝癌に対して、肝切除術が治療の第一選択であるとされています。
「大腸癌診療ガイドライン」でも、根治切除可能な転移性肝癌に対しては肝切除術が推奨されると明記されています。
当科では、腫瘍個数に関係なく、以下の条件を満たせば手術適応としています。
- 耐術可能
- 原発巣が制御されているか、制御可能
- 肝外転移がないか、制御可能
- 肝転移巣の根治切除が可能
- 十分な残肝機能の保持
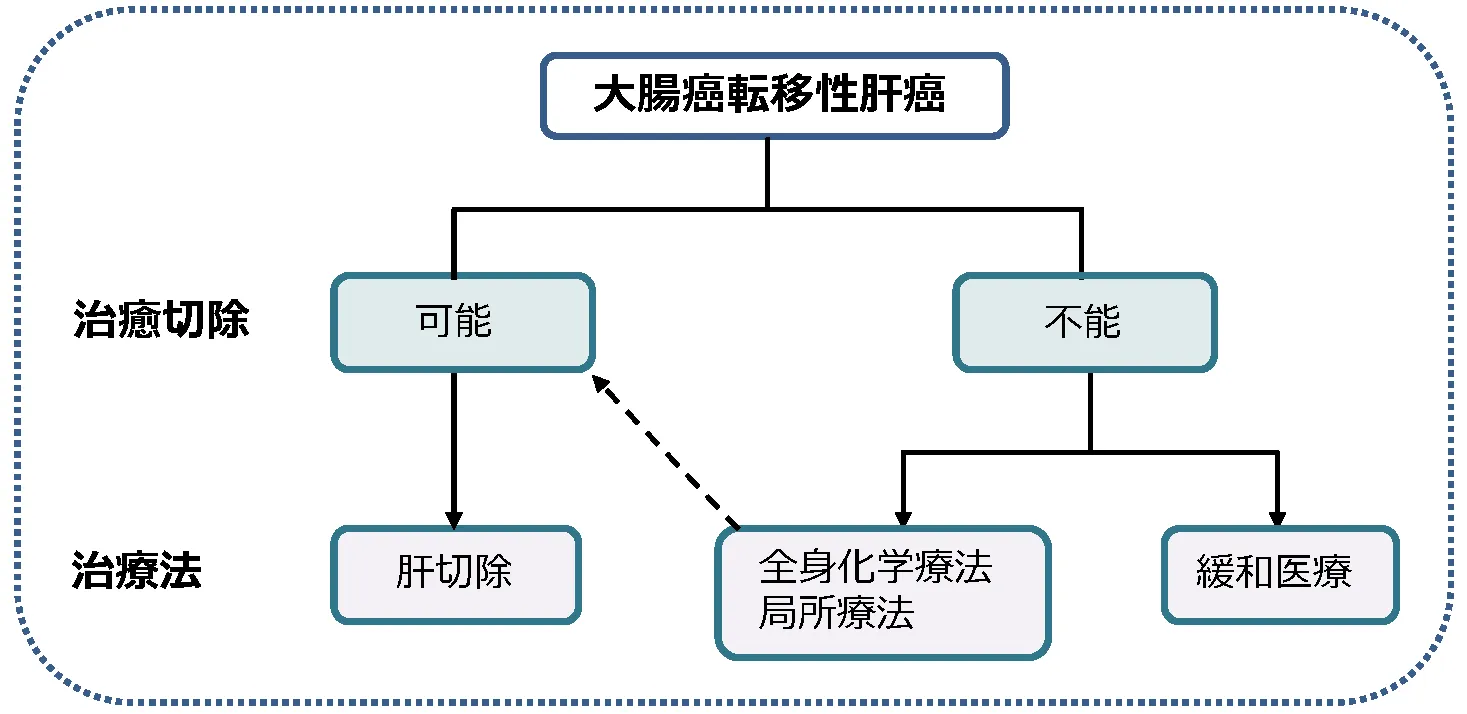
転移性肝癌に対する肝切除術式
転移性肝癌に対する肝切除は、部分切除を基本術式としていますが、癌の個数と局在、主要な血管への浸潤の有無、などにより大量肝切除を要することもあります。
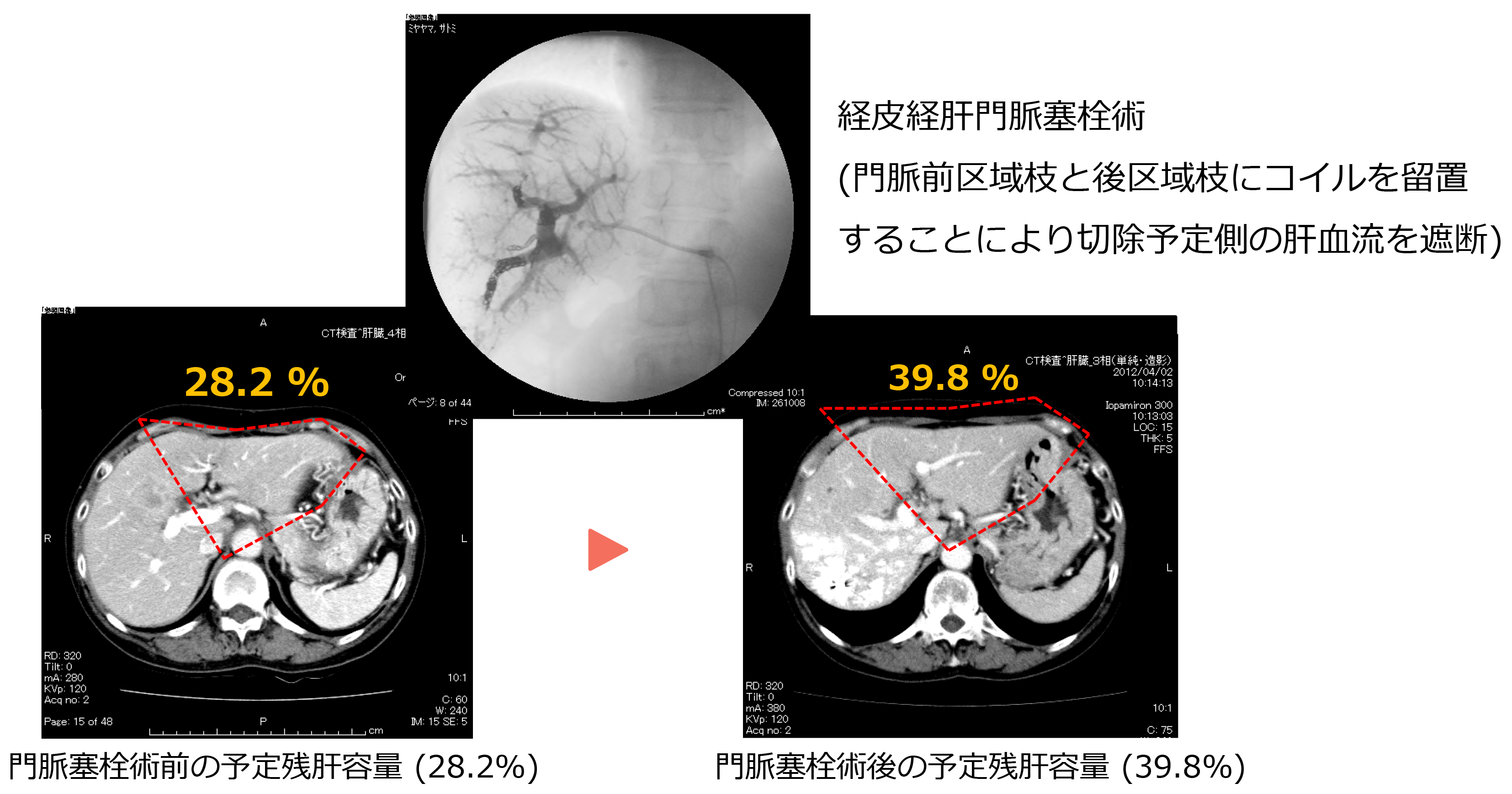
肝細胞癌と同様に、術前に3D肝切除シミュレーション(手術の肝切除体積予測・血管ナビゲーション)を用いて肝臓の容積や各血管の支配領域を測定し、安全で確実な手術を実施しています。測定時に残肝容積が過小と判断される場合には、術前に門脈塞栓術(切除予定側の門脈を塞栓することで、温存予定側の肝臓の代償性肥大を促す手技)を行い、術後肝不全を予防します。
また、補助化学療法を行うことにより、転移巣の大きさ・数を改善させて肝切除を安全に行うといった集学的治療にも積極的に取り組んでいます。
切除不能な転移性肝癌
他院で、切除不能な転移性肝癌、いわゆる“病気が進行しすぎていて手術ができない”、“予後は数ヶ月です”と言われた転移性肝癌の患者さんも来院されます。
しかし、治るためにはどこかのタイミングでがん病巣をすべて切除する手術治療が必要です。
切除不能な転移性肝癌に対して、
- 門脈塞栓術を行い、残る予定の肝臓を大きくしてから肝切除を行い、全腫瘍を切除する
- 化学療法を施行し、腫瘍を小さくした後に肝切除を行い、残存している腫瘍を切除する
(コンバージョン手術) - 2度に分けて(2期的)肝切除を行い、全ての腫瘍を切除する
(状況によっては、マイクロ波凝固壊死療法やラジオ波焼灼療法を併用)
などの治療により、がんの根治を目標にしています。
化学療法単独での治療には限界があり、がん細胞を完全には死滅できません。そこで、さまざまな治療方法を併用することで、切除不能とされる転移性肝癌も根治を目指すことが可能となります。
門脈塞栓術
残肝容積が過小と判断される場合には、術前に門脈塞栓術(切除予定側の門脈を塞栓することで、温存予定側の肝臓の代償性肥大を促す手技)を行い、術後肝不全を予防することがあります。
化学療法
化学療法は、イリノテカン(CPT-11)やオキサリプラチン(L-OHP)など新規抗癌剤と、ここ数年の分子標的治療薬の導入により最近10年で格段の進歩を遂げています。治療成績は大きく延び、化学療法は新しい時代を迎えたといえます。それにより、近年、切除不能な大腸癌肝転移症例に対し化学療法を施行し、腫瘍が縮小した後に行う手術が注目されています。
そこで、切除不能進行・再発症例に対して術前化学療法を施行することにより転移巣の大きさ・数を改善させて肝切除を安全に行うといった集学的治療にも積極的に取り組んでいます。
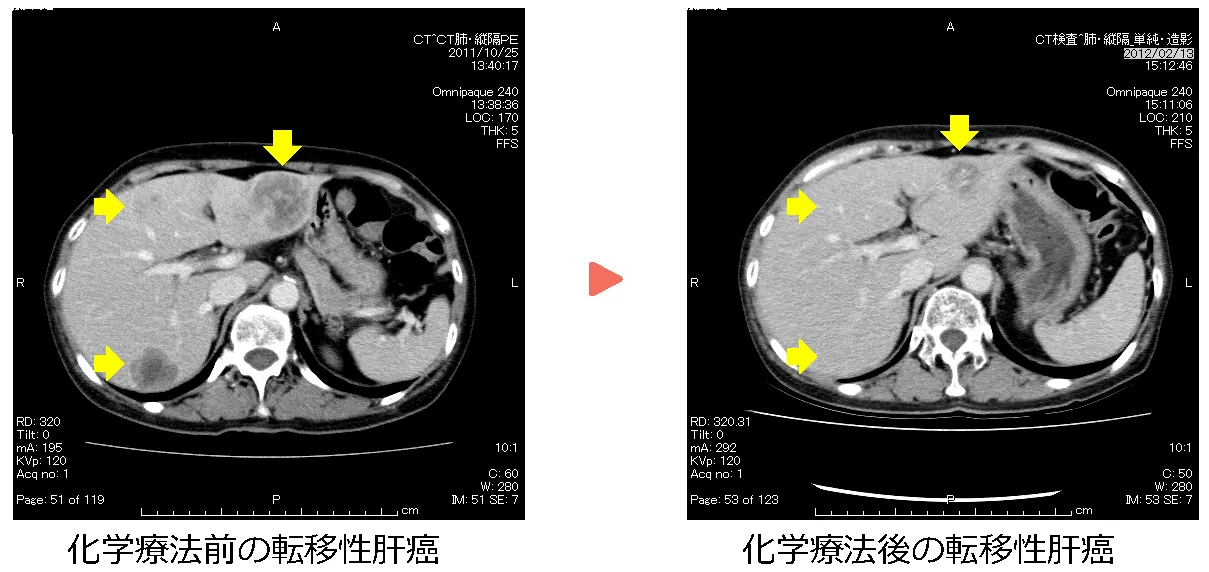
症例①:57歳 女性
2014年11月にS状結腸癌同時性肝転移と診断。2014年11月に腹腔鏡下S状結腸切除後、化学療法の後に2015年12月に肝切除(図)。その後、2021年12月現在、無再発生存中。
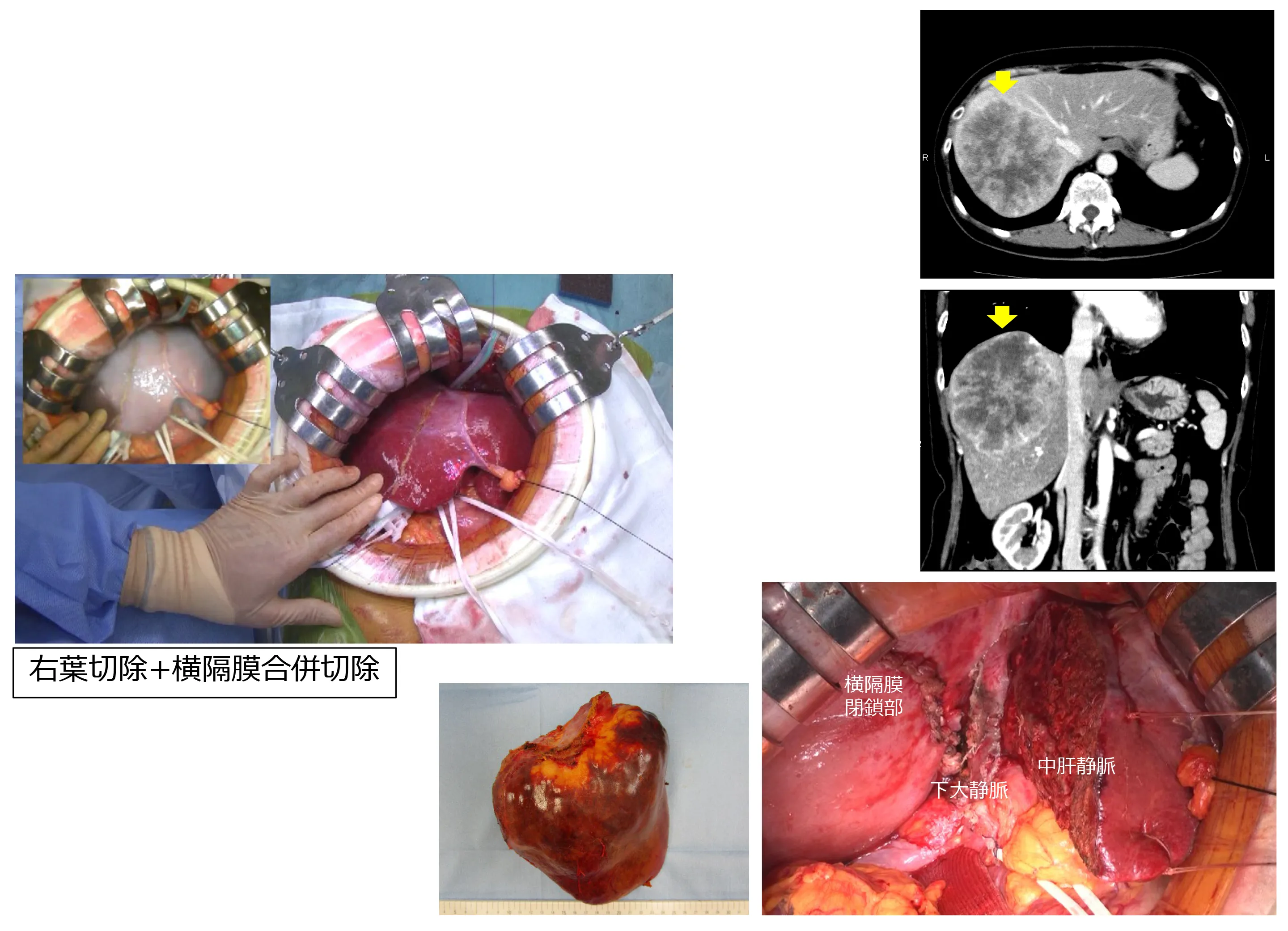
症例②:67歳 女性
2016年9月に直腸癌同時性肝転移と診断。化学療法の後、2017年10月に腹腔鏡下S状結腸切除、2017年11月に17ヶ所の肝転移巣を腹腔鏡下肝切除、2018年10月に4ヶ所の肝切除、2019年10月に2ヶ所の肝切除、2021年12月現在生存中。
■腹腔鏡下肝S6,7,8/7,8,8,8,4,5,5,3,3/2部分切除(17ヶ所の肝転移巣に対して12ヶ所の腹腔鏡下肝切除)